罕见病领域再迎来利好政策。
9月20日,国家卫健委官网公布由该部门联合科技部、工信部、国家药监局、国家中医药局、中央军委后勤保障部等六部门联合制定的《第二批罕见病目录》,共有86种罕见病纳入其中。加上2018年5月五部门发布的《第一批罕见病目录》,目录已覆盖207种罕见病。
9月21日,澎湃新闻记者梳理发现,多家A股和港股上市公司旗下产品的适应证进入上述目录。多位业内人士向澎湃新闻记者指出,目录扩容意味着国家层面对罕见病的更大关注,而进入国家罕见病目录后,将有望加速相关产品的审批进度,加快产品上市时间,让更多罕见病患者获益。

第二批罕见病目录部分病种
政策不断发力罕见病领域
《第二批罕见病目录》并不突然,早在今年1月,国家卫健委官网公布的一份针对《关于加大对罕见病诊治投入力度的建议》的答复中就提到,国家卫健委将按照罕见病目录制订工作程序,适时调整更新第二批罕见病目录。
罕见病,又称孤儿病,是指发病率极低、患病总人口数极少的疾病,具有种类多、遗传为主、诊断难、病情重、可治性低、治疗费用昂贵等特征。目前,全世界已发现7000多种罕见病,但仅有10%的罕见病有相应的治疗方法。
在解决罕见病问题上,相关部门在不同方向做着努力。
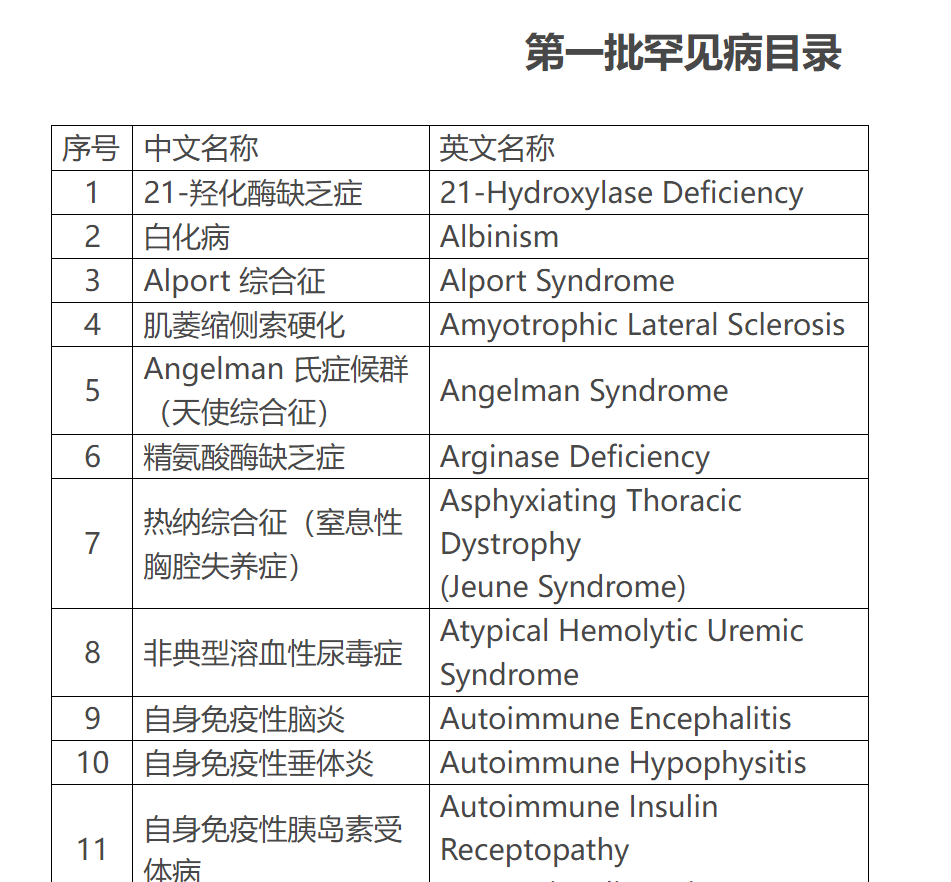
第一批罕见病目录部分病种
2019年,配合《第一批罕见病目录》的出台,国家卫生健康委制定印发《罕见病诊疗指南》,对纳入罕见病管理的121种疾病逐一明确诊疗指南,并依托行业组织开展医务人员培训,提高罕见病规范化诊疗能力。同时,依托全国罕见病诊疗协作网办公室,在协作网医院间开展医师培训,提高医生对罕见病诊断和治疗的能力。
药品审批也对罕见病药物倾斜。2020年3月发布的《药品注册管理办法》指出,临床急需的境外已上市境内未上市的罕见病药品,审评时限为七十日。2022年5月,《药品管理法实施条例(修订草案征求意见稿)》提出,罕见病新药在不断供情况下可拥有不超过7年的市场独占权,期间不再批准相同品种上市。
国家医保局在解决罕见病药物支付问题上也取得进展。2022年医保目录调整工作中,7款罕见病用药通过医保谈判被纳入其中,有产品降价超90%。据央视新闻2023年1月报道,我国医保目录包含52种罕见病用药,覆盖27种罕见病。
一位不愿具名的国内药企人士向澎湃新闻记者表示,2018年,五部委联合发布《关于公布第一批罕见病目录的通知》,这份文件在业内被认为是吹响了罕见病诊疗的“集结号”,此后医保对罕见病品种的倾斜,包括这次目录扩容,都显示了国家政策在这一领域的持续发力,由衷希望更多的罕见病被看见,更多罕见病患者的需求被关注,被切实解决。
另一位关注罕见病的国内药企人士此前曾向记者表示,新药研发“九死一生”,风险极高,罕见病药物更是如此。很多药企其实都有研究罕见病的想法,但很多时候不知道这类产品未来在国内是不是有真正的前景,所以不敢真的去做。可以看到,近些年,政策端对罕见病的支持越来越多,相信会鼓励更多力量参与其中,解决罕见病面临的难题。
多款已上市或在研的罕见病适应证进入罕见病目录
根据弗若斯特沙利文预测,国内罕见病药物市场2020年达到13亿美元,2030年或增长到259亿美元。千亿赛道吸引着药企巨头和大批新兴生物医药公司进入。
从最新公布的《第二批罕见病目录》来看,86种罕见病包括神经母细胞瘤、神经纤维瘤病、腱鞘巨细胞瘤、泛发性脓疱型银屑病等,涉及肿瘤、皮肤、风湿免疫、内分泌、肿瘤等多个疾病领域,其中部分罕见病已经有或处于临床研究后期的药物。
再鼎医药(9688.HK)的管线产品适应证中有5个入选此次罕见病目录,包括慢性炎性脱髓鞘性多发性神经根神经病(CIDP)、胃肠间质瘤(GIST)、胶质母细胞瘤(GBM)、恶性胸膜间皮瘤(MPM)、天疱疮等。
再鼎医药方面向澎湃新闻记者表示,随着本次罕见病目录的发布,相信未来在相关政策的指引下,更多针对罕见病的突破性解决方案将不断涌现。保障罕见病治疗不只是医学问题,更是亟待解决的社会问题。“疾病罕见但待遇不应罕见”,期待全社会携手,改进和解决中国罕见病患者的治疗困境,加速中国罕见病事业的发展。
和誉医药(2256.HK)的第一个产品Pimicotinib(ABSK021)的一个适应证腱鞘巨细胞瘤进入了此次罕见病目录。2023半年报显示,该药已经在中国、美国和欧洲同步开展全球III期研究。
和誉医药方面向澎湃新闻记者介绍,腱鞘巨细胞瘤虽然是罕见病,但中国患者每年新增6万到7万,存量患者30万至40万,国内患者数量并不罕见,此次适应证入选罕见病目录将有望加速产品的审批进度,加快产品上市时间,让腱鞘巨细胞瘤患者尽早获益。
泛发性脓疱型银屑病位列此次罕见病目录之中,澎湃新闻记者注意到,国内针对这种罕见病已经有上市或在研的产品。今年5月,知名跨国药企勃林格殷格翰宣布,针对泛发性脓疱型银屑病(GPP)创新靶向生物制剂佩索利单抗注射液已经开始正式应用于临床,该病的治疗进入精准靶向时代。
华海药业(600521)旗下的华奥泰正在进行泛发性脓疱型银屑病相关药物研发。2023半年报显示,这款药的代号为HB0034,目前其临床重点开发的适应证就是泛发性脓疱型银屑病。奥泰已在新西兰和中国开展的三期项临床研究显示,HB0034在健康志愿者和 GPP患者中的安全性耐受性均良好。目前 HB0034 已经向美国食品药品监督管理局(FDA)提交孤儿药认定申请,同时,华奥泰也与国家药审中心(CDE)保持积极的沟通,加快推进相关临床工作。
神经纤维瘤病也在此次罕见病目录中,而今年5月,阿斯利康中国宣布,硫酸氢司美替尼胶囊在中国正式获批用于治疗3岁及3岁以上伴有症状、无法手术的丛状神经纤维瘤的I型神经纤维瘤病儿童患者。对于《第二批罕见病目录》的意义,阿斯利康方面向澎湃新闻记者表示,目录的出台体现了国家对于完善罕见病诊疗与保障体系的决心,目录的出台能进一步提升对于罕见病的认知、加强罕见病的诊疗能力、促进罕见病药物研发和可及,使更多罕见病患者受益。阿斯利康也将继续加速引入罕见病创新药品,联合行业生态,为更多罕见病患者造福。
上述不愿具名的药企人士也指出,对于药企而言,罕见病药物的研发是“更有温度的创新”。当前,如何进一步破解罕见病药物医保准入后的“最后一公里”难题,切实保证罕见病患者药物可及,仍有很长的路要走。
(责任编辑:张紫祎)























 客服
客服 小程序
小程序

 公众号
公众号

 工具箱
工具箱
